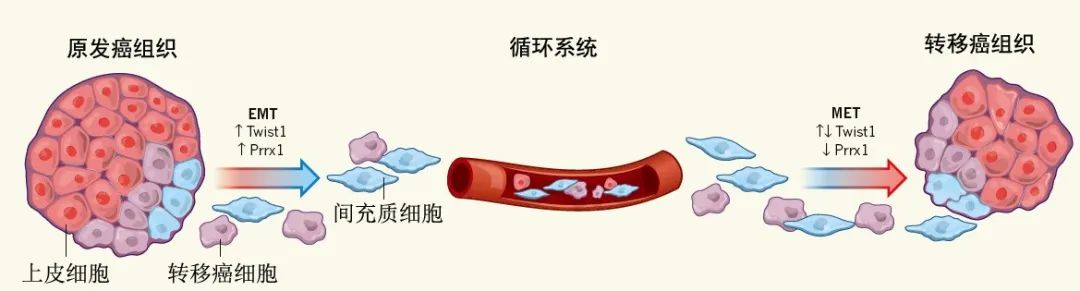
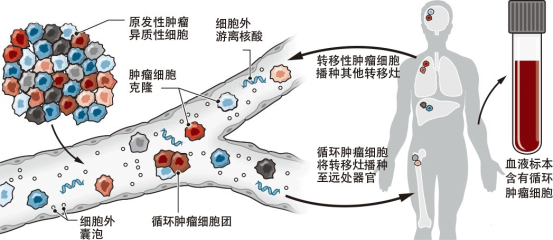
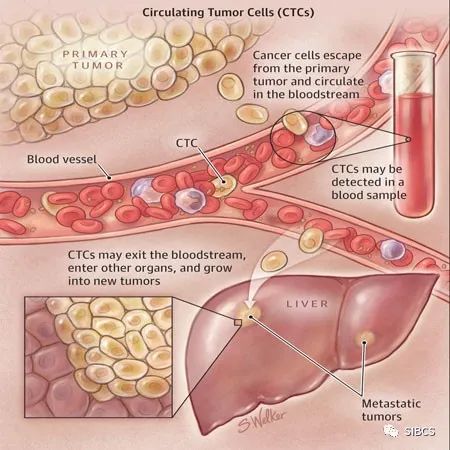
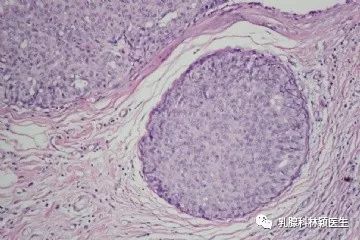
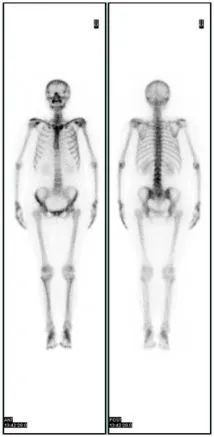
众所周知,诊断肿瘤的金标准是病理切片检查,切片的组织来源多为手术活检和穿刺活检。那么什么是液态活检呢?顾名思义,液态活检是通过血液测试来监测肿瘤,主要监测肿瘤或转移灶释放到血液的循环肿瘤细胞(CTCs)和循环肿瘤DNA(ctDNA)碎片,是检测肿瘤和癌症、辅助治疗的突破性技术。它的优势在于通过非侵入性取样以降低活检对机体的危害。目前临床开展较多的液体活检是循环肿瘤细胞(circucellslating tumor cells,CTCs),就是指从原发肿瘤上脱离出来并进入血液循环系统中的细胞,虽然在其转移的过程中,大部分已经被机体的免疫系统所拦截并消灭,但是还是会有一部分能够生存下来,并且有可能形成转移灶,因此这类存在于血液系统中的肿瘤细胞是值得我们关注和警惕的。 在国外某一项集合了20个研究中心,1944例转移性乳腺癌患者的研究中发现,治疗前CTCs≥5个/7.5ml的患者的总生存期(OS)和无进展生存期(PFS)要明显低于CTCs≤5个/7.5ml的患者。在非转移性乳腺癌患者中,CTCs也是无病生存期(DFS)的独立预测因子,有不同中心的研究表明,CTCs≥1个/7.5ml的患者的DFS及OS均低于CTCs检测为阴性的患者。2018版的AJCC指南也指出临床晚期乳腺癌外周血CTCs≥5个/7.5ml,临床早期乳腺癌外周血CTCs≥1个/7.5ml均提示提示预后不良,其证据水平为II级。 检测CTCs的方法不同,其结果及临床意义亦有差别!比如我们医院(中日友好医院)是以CTCs≥10.08FU/ml判读为阳性结果,即外周血中存在肿瘤细胞的可能性大,高度怀疑恶性肿瘤或提示转移风险相对较高;8.70-10.08为灰区(阳性可疑),应重新抽取样本进行检测或在一定时间后随访检测;<8.70则判读为阴性,提示为健康人,或良性病变/肿瘤细胞可能暂未进入外周血循环。对于某些高复发风险的患者检测CTCs也是我们制定治疗方案的重要因素。 影像学检查诸如CT、MRI、PET等是乳腺癌疗效评估及复查监测的重要手段,但因放射线的损害及价格的高昂也为患者带来了许多经济上的负担及心理上的担忧。在国外一项前瞻性的关于转移性乳腺癌患者的研究中发现,化疗前后动态监测患者的CTCs的数目,发现CTCs的数目在化疗后3~4周就出现了改变,而影像学的改变需要9~12周。国内某一项纳入了136例转移性乳腺癌的研究也发现,化疗后CTCs数目下降或不变的患者的预后要好于CTCs数目增加的患者。故对于转移性乳腺癌患者的解救治疗,CTCs数目的变化对疗效及预后具有一定的提示作用。 我们临床上也观察到CTCs的变化对疗效评估及方案制定具有重要作用。如冯某某,乳腺癌脑转移、骨转移患者,但因脑转移灶已手术切除,骨转移病灶又不能通过影像医学精准评估,我们通过监测其治疗前后CTCs,分别为31.1FU/ml(2019.1.4)和11.4FU/ml(2019.4.11),CTCs明显下降,故提示治疗有效,效不更方,可继续原方案维持治疗。 1.早在2010年AJCC(美国癌症联合委员会)制定的《肿瘤分期指南》(《Cancer Staging Manuel》)第七版中,就已经首次把CTCs列入 TNM分期系统,作为一个新的M分期(远端转移)标准,列为cM0(i+)分期(即为无任何转移性临床症状或体征,无远处转移的临床或影像学证据,但通过分子检测或显微镜检,在循环血液、骨髓或其他非区域淋巴结组织中发现肿瘤细胞或≤0.2mm的微小转移灶),介于M0和M1之间。 2. 2017.v3版NCCN指南,正式引入cM0(i+)分期。再次确认了引入CTC完善肿瘤分期系统的重要意义。 3. 2018的 AJCC第八版癌症分期系统中,除保留cM0(i+)分期外,更进一步明确了CTC检测的临床价值。该指南将CTC列为继ER/PR、HER2、Ki67和肿瘤组织学分级四项生物学指标之后的又一项乳腺癌预后评估工具。 4. 2019.4的中国临床肿瘤学会(CSCO)的《2019 CSCO乳腺癌诊疗指南》也新增加了循环肿瘤标记物的章节,详细介绍了CTC及其相关技术。 总而言之,虽然液体活检已经被临床广泛应用,但还是存在很多局限性!首先,液体活检尚不能用于肿瘤早筛。早筛是指对肿瘤的预测,以及早期肿瘤的检查。因为只有当肿瘤生长到一定阶段后,CTC或者ctDNA进入血液,才能通过液体活检的方式检测出来。而此时,肿瘤往往已经生长到一定规模,不再是早期肿瘤了。其次,液体活检技术不是传统检查的替代技术。肿瘤的初步诊断、确诊和疗效评估,应该根据实际情况,结合影像、肿瘤标志物和液体活检等检查方式综合判断。液体活检在一定程度上解决了传统技术的部分局限性,但尚不足以替代传统检测技术。 
为什么要检测循环肿瘤细胞?
提示预后
监测疗效
国内外各大指南推荐